1998年,曲妥珠单抗被批准成为首个实体肿瘤靶向治HER2+乳腺癌的药物,其显著改善了这部分患者的疾病进展时间、提高客观缓解率、改善总了生存,从此开启了“曲妥珠时代”。随着临床研究以及医保政策的推动,HER2阳性患者已经从曲妥珠单抗走进了曲帕双靶时代,进一步改善预后。但并非所有HER2阳性的所有患者能从此得到治愈,难治高危的患者不可避免走向耐药甚至复发转移。寻找从靶点机理、药物结构等多个角度尝试进行突破, 例如抗体功能优化、双特异性抗体、ADC改进等等,堪称为这些患者的治愈之路陆续点燃希望之光与治愈之光。
上述探索中,后曲妥时代ADC和不可逆TKI两大类药物被认为是数据最充分、应用最有前景的并起双雄。这二者针对HER2这个经典的靶点还能继续拓展出进一步的生存空间和临床价值,点燃了照亮“阴暗面”的希望之光,堪称the light on the dark side of the moon。并且笔者认为曲妥后时代的探索不应局限于晚期,理应覆盖更广阔,领域更深刻,其展望探索的空间在早期乳腺癌的新辅助、高危辅强、脑转移的治疗预防等各个领域均有体现,详述如下。
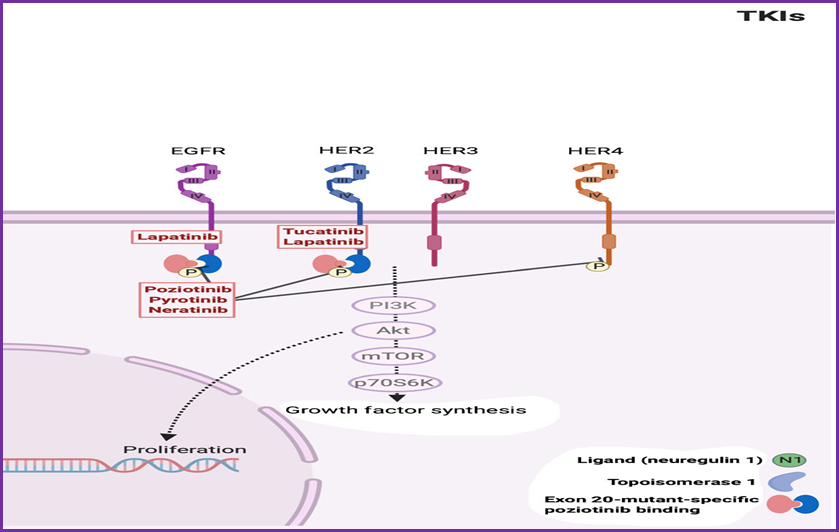
TKI穿过细胞膜,结合到胞质的酪氨酸激酶的ATP结合部位,直接抑制磷酸化和下游级联反应,发挥杀伤作用。胞内作用能抑制胞外大分子耐药的同时,TKI和大分子单抗以及ADC药物亦无交叉耐药,具有协同效应。所谓“小分子大作为”,代表着小分子药物未来的无限可能。
吡咯替尼是不可逆的酪氨酸激酶抑制剂,作用靶点为HER1、HER2、HER4。在吡咯替尼联合卡培他滨在HER2阳性转移性乳腺癌的Ⅱ期研究中,ORR达78.5%,研究PFS达18.1个月。吡咯替尼联合卡培他滨在HER2阳性转移性乳腺癌的Ⅲ期PHENIX研究中,主要研究终点PFS达11.1个月,与安慰剂相比疾病进展风险降低82%。吡咯替尼联合卡培他滨在HER2阳性转移性乳腺癌的Ⅲ期PHOEBE研究中,主要研究终点PFS达12.5个月,与拉帕替尼联合卡培他滨相比疾病进展风险降低61%。
奈拉替尼是不可逆的酪氨酸激酶抑制剂,作用靶点为HER1、HER2、HER4。奈拉替尼联合卡培他滨在HER2阳性转移性乳腺癌的Ⅲ期NALA研究中,主要研究终点PFS达8.8个月,与拉帕替尼联合卡培他滨相比疾病进展风险降低24%。
图卡替尼:HER2CLIMB研究结果显示,在曲妥珠单抗、帕妥珠单抗和T-DM1经治的HER2阳性晚期乳腺癌患者中,图卡替尼联合曲妥珠单抗+卡培他滨组的mPFS为7.8个月,与曲妥珠单抗+卡培他滨组(5.6个月)相比显著降低疾病进展或死亡风险46%。
HER2阳性是脑转移的重要危险因素,HER2阳性乳腺癌患者出现脑转移的风险增加2-4倍1。大分子单抗类药物不能穿越人体的血脑屏障,虽然发生转移或治疗后BBB会被破坏且曲妥珠单抗放射性同位素研究显示其能在HER2阳性MBC患者脑部转移灶聚集,但局部是否能达到有效治疗浓度仍存疑问。故有观点认为曲妥珠单抗仍能改善CNS转移HER2阳性MBC患者的生存主要来源于其对总体肿瘤负荷的有效控制。
一项纳入了5项曲妥珠单抗辅助研究的meta分析(N=11186)结果表明2,曲妥珠单抗辅助治疗后脑转移作为第一复发部位的发生率有增加的趋势:具有CNS转移复发风险的患者在曲妥珠单抗治疗人群中可能更多;在曲妥珠单抗阻止总体疾病进展后,中枢神经系统转移的风险似乎在按比例地增加。
提到脑转移的控制与治疗,TKI在该领域可谓是得天独厚,数据优势无限。NEfERT-T研究结果提示,奈拉替尼 vs 曲妥珠单抗的CNS复发进展风险为8.3% vs 17.3%(HR=0.48;95% CI:0.29~0.79;P=0.002),2年CNS累积复发率为16.3% vs 31.2%(HR=0.45;95% CI:0.26~0.78;P=0.004),且无论基线是否存在脑转移,奈拉替尼的治疗效应都存在3,4。NALA研究结果提示,奈拉替尼联合卡培他滨与拉帕替尼联合卡培他滨相比,可显著延迟CNS干预时间5。
HER2CLIMB研究纳入了比例不小的进展期脑转移的患者,结果提示,对于既往接受过曲妥珠单抗、帕妥珠单抗和T-DM1治疗的晚期HER2阳性乳腺癌,图卡替尼联合曲妥珠单抗+卡培他滨可显著降低疾病进展或死亡风险,并且图卡替尼联合方案显著降低了脑转移患者疾病进展或死亡风险6。PHENIX研究结果提示,对于基线有脑转移的患者,吡咯替尼联合卡培他滨显著延长患者的PFS,且治疗后至脑转移进展的时间更长,脑转移进展的患者比例更低。对于基线无脑转移的患者,吡咯替尼+卡培他滨组出现的新发脑转移的患者比例更低,治疗后至新发脑转移的出现时间更长7。2021年ASCO大会公布的吡咯替尼治疗HER-2阳性晚期乳腺癌脑转移研究结果显示,对于未经局部放疗的脑转移患者,吡咯替尼联合卡培他滨方案的CNS-ORR达74.6%,mPFS达11.3个月;对于局部放疗后再次进展的脑转移患者,吡咯替尼联合卡培他滨方案的CNS-ORR为42.1%,mPFS依然有5.6个月8。同时,美国癌症研究协会《临床癌症研究》在线发表的一项真实世界研究结果显示,HER2+乳腺癌脑转移患者使用含吡咯替尼方案的mPFS达8.67个月,mOS为13.93个月9。以上的多项吡咯替尼研究结果提示了其治疗HER2+乳腺癌脑转移优秀的疗效与潜力。
TKI同样在新辅助和辅强领域均有涉足与收获。双抗HER2新辅助治疗的研究首先来自于拉帕替尼:NeoALTTO、CALGB 40601和NSABP B-4126。NeoALTTO研究在术前给予6周的L/H/HL序贯12周的TL/TH/THL,术后3周期FEC序贯34周的L/H/HL,结果提示,无论激素受体状态,THL方案与TH组相比均显著提高pCR率(51.3% vs 29.5%,P=0.0001)和tpCR率(46.8% vs 27.6%,P=0.0007)8。CALGB 40601研究结果提示,对于激素受体阴性、HER2基因扩增、p53基因突变、某些免疫细胞浸润的HER2阳性早期乳腺癌,拉帕替尼可显著提高紫杉醇+曲妥珠单抗新辅助治疗pCR率。在总人群中,THL方案相比TH方案展现出pCR的获益趋势,尽管无统计学意义(56% vs 46%,P=0.13),但在HR-的人群中,HL双靶方案与H单靶方案相比pCR显著获益(79% vs 54%,P=0.01),且THL组相较于TH组的复发风险有显著差异(HR=0.32,95%CI:0.14~0.71,P=0.005)9。我国学者也陆续开展了吡咯替尼的一系列新辅助治疗的初步尝试,均在缓解率上取得了相当不俗的结果,后续大型新辅助的Ⅲ期临床研究也正在进行,我们静候佳音。
辅强方面, 奈拉替尼先行一步,ExteNET研究纳入2840名经新辅助/辅助曲妥珠单抗经治的HER2+早期乳腺癌患者,持续一年的口服奈拉替尼240毫克和安慰剂对比。经过5年的随访,与安慰剂相比,使用奈拉替尼的iDFS绝对获益在HR+/≤1年人群中为5.1%,在HR+/>1年人群中为1.3%,提示在完成曲妥珠单抗治疗后不久开始服用奈拉替尼的患者有更明显和持久的反应,在HR+/≤1年人群中,重要的临床终点指标DDFS绝对获益为4.7%。在8年的最终OS分析中,HR+/≤1年的non-pCR亚组观察到显著的OS获益,来那替尼组的绝对OS获益达到了9.1%,降低死亡风险53%10。奈拉替尼组5年时首次CNS累积复发率为0.7%,而安慰剂组为2.1%,CNS-DFS的危险比为0.41;95%CI为0.18~0.85)。本研究的结果进一步证实了TKI在辅助强化抗HER2治疗当中的价值,不但拥有结构优势,控制尚佳,预防亦趋势可见。
在抗体功能优化、双特异性抗体、ADC改进一系列措施之中,改进的抗体偶联物(antibody-drug conjugate,ADC)研发与应用更具优势,其独特的结构设计给予精准打击+效力加倍,前景广阔而光明。这类药物通过特定的连接头将靶标特异性的单克隆抗体与高杀伤性的细胞毒性药物偶联起来的靶向生物药剂,以单克隆抗体为载体将小分子细胞毒性药物以靶向方式高效地运输至目标肿瘤细胞中。
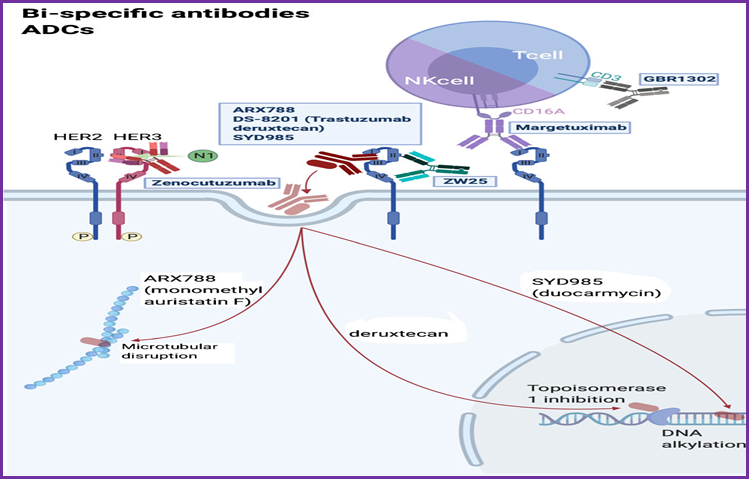
T-DM1开创了ADC药物的先河之后,Trastuzumab-deruxtecan(DS-8201)将这一思路发扬光大。进一步改进了细胞毒荷载和同抗体连接的化学键,药抗比更高,其荷载物拓扑异构酶I抑制剂具有高比例、高效,半衰期短,连接稳定,以及特有的膜渗透性,释放入血会对其它临近细胞造成杀伤,此所谓“旁观者不旁观”。
DS-8201的关键性Ⅱ期DESTINY-Breast01研究结果提示,对于中位治疗线数为6线的晚期HER2+乳腺癌,DS-8201展现出了优秀的疗效,ORR达61.4%,DCR达97.3%,DOR达20.8个月,mPFS达19.4个月13。2021年ASCO进一步更新了DESTINY-Breast01研究中脑转移患者的治疗情况14。基线经治的、无症状且无需治疗控制症状的24例脑转移患者经过DS-8201的治疗,脑转移灶ORR为58.3%(95%CI:36.6%~77.9%),mPFS为18.1个月(95%CI:6.7~18.1),中位缓解持续时间(mDoR)为16.9个月(95%CI:5.7~16.9)。这一结果与所有184例患者的结果一致(ORR为60.9%,mPFS为16.4个月,mDoR为14.8个月),提示DS-8201对脑转移病灶同样发挥着明确持久的缓解控制作用。
缘于目前新型ADC药物特有“旁观者效应”,DS-8201对HER2低表达患者(IHC 2+/ISH-, IHC 1+/ISH-,或IHC 1+/ISH未检测)依然显示出了非凡的治疗效果:DS-8201的一项Ib期研究纳入了HER2低表达且既往接受过多线治疗的患者,依然取得了优秀的结果,ORR为44.4%,DCR达83.3%,mPFS达8.0个月13,提示了DS-8201对于晚期HER2低表达人群的优异疗效。
此外,解救治疗领域中DS-8201还有多个关键临床正处于开发中,例如旨在评估DS-8201对比曲妥珠单抗/卡培他滨或拉帕替尼/卡培他滨治疗HER2+不可切除或转移性乳腺癌患者的疗效和安全性的DESTINY-Breast-02研究;评估DS-8201对比T-DM1用于HER2+不可切除或转移性乳腺癌患者二线治疗的疗效和安全性的DESTINY-Breast-03研究;评估DS-8201+/-帕妥珠单抗对比THP方案用于HER2+不可切除或转移性乳腺癌患者一线治疗的疗效和安全性的DESTINY-Breast-09研究。评估DS-8201对比研究者选择化疗治疗HER2低表达晚期乳腺癌的疗效的DESTINY-Breast-04。评估DS-8201对比研究者选择化疗治疗内分泌治疗后进展的HR+/HER2低表达或存在HER2表达的晚期或转移性乳腺癌的疗效的DESTINY-Breast-06。我们期待结果的公布,为晚期HER2阳性/HER2低表达乳腺癌的治疗提供新选择。
人们还在尝试开发新的ADC类药物。SYD985和BAT8001由Trastuzumab与新的毒素偶联而成,RC48则使用了比Trastuzumab更高靶点亲和力的单克隆抗体与毒素偶联,均已经在临床上显示出不错的前景。我们看到ADC药物不断推陈出新,未来做好差异化才是成功与收获的关键。
ADC在早期乳腺癌的应用收获更多体现在辅助强化的领域。KATHERINE研究就是抗HER2强化治疗的成功范例,该研究对新辅助治疗后non-pCR的HER2阳性乳腺癌患者应用T-DM1进行强化治疗,结果显示与单独曲妥珠单抗治疗相比可显著改善iDFS和DDFS16。虽然囿于当时对照组仅为曲妥珠单抗单靶向治疗,但这种辅助强化的理念给了我们很多的启示,确立了高危患者术后辅助的新标准。新型ADC类药物也从晚期的探索迈向了早期辅助强化,乃至新辅助治疗阶段。DESTINY-Breast 05研究中将DS-8201与T-DM1头对头比较用于新辅助治疗后有残留病灶(non-pCR)高复发风险的HER2+乳腺癌患者的治疗,评估DS-8201在辅助强化治疗上的疗效与安全性17。另一项旨在评估HR阳性HER2低表达乳腺癌人群中接受DS-8201±阿那曲唑的新辅助治疗研究(NCT04553770)也正在进行,探索ADC药物单药或联合内分泌治疗在新辅助治疗上的潜力18。
基于TKI和ADC类药物在HER2+乳腺癌中的疗效,且二者无交叉耐药,内外交融值得期待,目前已有这方面的探索正在进行。包括评估图卡替尼联合T-DM1对比T-DM1治疗既往新辅/辅助/晚期接受过曲妥珠单抗或紫杉类治疗HER2+晚期乳腺癌疗效的HER2CLIMB-02研究;评估图卡替尼联合DS-8201治疗HER2+局部晚期/转移性乳腺癌疗效与安全性的HER2CLIMB-04研究。期待结果的公布,为乳腺癌治疗提供新思路。
曲妥珠针对HER2精准靶点抑制联合ADCC改善生存成为治疗基石,由此开创曲妥时代;然而通路上调、结合障碍、替代激活、基因突变、抑制欠缺、异质表达等等一系列原因导致的“曲妥内卷”迫切需要治疗加法。此前“后曲妥时代”更多观点聚焦在晚期解救领域,其实无论早期新辅助或者辅强领域均有喜讯传来,早期新辅加法不唯pCR ,辅强也可精准获益。迄今为止“小分子大能量”的不可逆TKI与“旁观者不旁观”的创新ADC双雄并起成绩斐然,未来会覆盖更广阔,收获更深刻,重塑格局乃大势所趋。拥有the light on the dark side ,我们相信HER2靶点亦会无畏黑暗,迎接光明未来。
四川省人民医院乳腺科
副主任医师 硕士生导师
中华医学会肿瘤学专委会乳腺学组青委委员
中国整形美容协会乳房修复与再造专业委员会委员
中国医药教育协会乳腺疾病专委会委员
四川省女医师协会乳腺专委会副主任委员
四川省抗癌协会乳腺专委会青年委员会副主任委员
四川省医师协会乳腺专委会青年委员会副主任委员
成都高新医学会乳腺专委会候任主委
1. Mehta AL, et al. Cancer Treat Rev 2013; 39:261–269.
2. Bria E, et al. Breast Cancer Res Treat 2008; 109:231–239.
3. Awada A, et al. JAMA Oncol 2016; 2:1557–1564.
4. Awada A, et al. ASCO 2015 (Abstract 610, poster presentation).
5. Cristina S. et al., J Clin Oncol., 2020 Sep 20;38(27):3138-3149.
6. Murthy RK, et al. N Engl J Med. 2020 Feb 13;382(7):597-609.
7. Min Y. et al., Transl Breast Cancer Res, 2020 May 26.
8. Baselga J. et al., Lancet. 2012 Feb 18;379(9816):633-40.
9. Fernandez-Martinez A, et al. J Clin Oncol. 2020. 38.
10. Arlene C. et al., Clin Breast Cancer; 2021 Feb;21(1):80-91.e7.
11. Scaltriti M, et al. J Natl Cancer Inst. 2007;99:628-38.
12. Binghe X et al., Lancet Oncol 2021; 22: 351–60.
13. Shanu Modi et al. Antitumor Activity and Safety of Trastuzumab Deruxtecan in Patients With HER2-Low–Expressing Advanced Breast Cancer: Results From a Phase Ib Study. J Clin Oncol. 2020.
14. Guy Heinrich Maria Jerusalem, et al. JCO 2021 39:15_suppl, 526-526
1. Peter Schmid, et al. ASCO 2021.Abstract 1023
15. VON Minckwitz G, et al. NEJM, 2019, 380(7): 617-28
16. Charles E Geye Jr,et al.SABCS 2020.OT-03-01
17. https://clinicaltrials.gov/ct2/show/NCT04553770





 京公网安备 11010502033352号
京公网安备 11010502033352号